In lebenden Systemen sind Proteine essenzielle Biomoleküle, die eine Vielzahl von Funktionen erfüllen. Wie biologische Abläufe funktionieren, lässt sich leichter verstehen, wenn man ihre Struktur kennt. Ziel dieses Leitfadens ist es, die vier Ebenen der Proteinstruktur zu erklären und zu zeigen, wie Sie ein passendes Diagramm erstellen.
Das Verständnis der Proteinstruktur ist entscheidend, um biologische Prozesse im menschlichen Körper einzuordnen. Indem Proteinstruktur-Diagramme Struktur und Funktion visuell miteinander verknüpfen, werden biologische Konzepte leichter zugänglich. EdrawMax ist ein geeignetes Tool, um solche Diagramme zu erstellen.
In diesem Artikel
In lebenden Systemen sind Proteine essenzielle Biomoleküle, die eine Vielzahl von Funktionen erfüllen. Wie biologische Abläufe funktionieren, lässt sich leichter verstehen, wenn man ihre Struktur kennt. Ziel dieses Leitfadens ist es, die vier Ebenen der Proteinstruktur zu erklären und zu zeigen, wie Sie ein passendes Diagramm erstellen.
Was sind die 4 Ebenen?
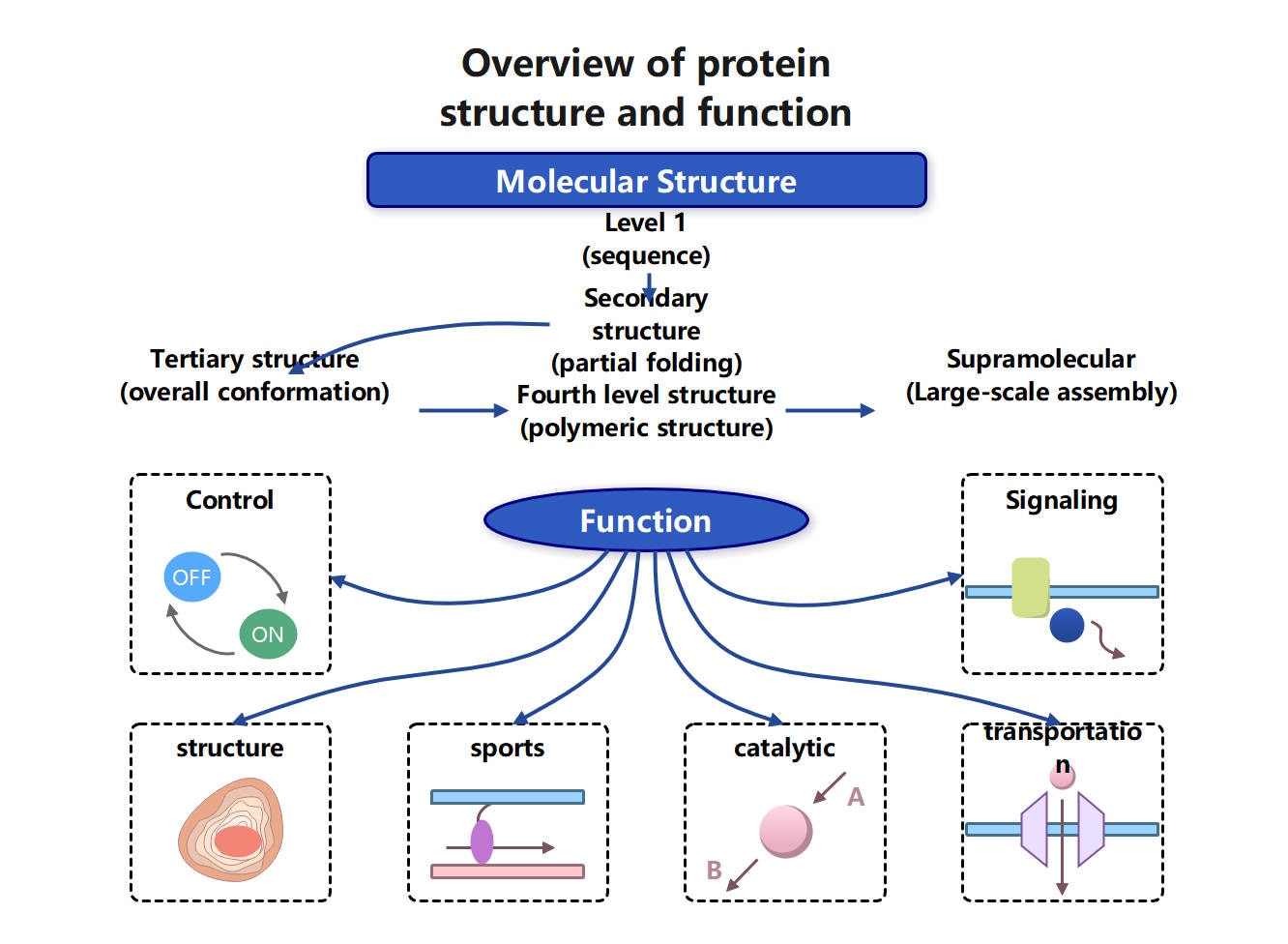
Proteine werden in vier Strukturebenen eingeteilt; mit jeder Ebene nimmt die Komplexität zu. Eine einfache Aminosäurekette faltet sich und bildet so ein funktionelles Biomolekül. Hier sind die vier Strukturen kurz erklärt:
- Primärstruktur: Eine lineare Aminosäurekette, die über Peptidbindungen verknüpft ist. Diese Sequenz enthält zugleich die Information für die korrekte Faltung.
- Sekundärstruktur: Entsteht, wenn sich die Kette in wiederkehrende Muster faltet. Beispielsweise werden α-Helices und β-Faltblätter durch Wasserstoffbrückenbindungen stabilisiert.
- Tertiärstruktur: Beschreibt die dreidimensionale Gesamtstruktur einer einzelnen Polypeptidkette.
- Quartärstruktur: Entsteht, wenn mehrere gefaltete Polypeptidketten (Untereinheiten) zu einem funktionellen Komplex zusammenlagern.
Struktur-Funktions-Zusammenhang
Die Struktur eines Proteins auf jeder Ebene bestimmt seine Funktion. Die Primärstruktur legt fest, wie ein Protein gefaltet wird, da Aminosäuren auf bestimmte Weise miteinander interagieren. Diese Wechselwirkungen beeinflussen, wie Sekundär- und Tertiärstruktur ausgebildet werden. Außerdem wird die dreidimensionale Struktur eines Proteins durch diese Interaktionen mitbestimmt.
Die endgültige Proteinform erzeugt Bindungstaschen, aktive Zentren und Interaktionsoberflächen. Dadurch können Proteine spezifische Aufgaben übernehmen, z. B. Katalyse oder Transport. Bereits kleine strukturelle Veränderungen können die Effizienz eines Proteins reduzieren.
Fehlgefaltete Proteine können ihre Funktion teilweise oder vollständig verlieren. Deshalb ist der Struktur-Funktions-Zusammenhang zentral, um normale Proteinaktivität zu erklären.
Primär- und Sekundärstruktur
Alle höheren Organisationsebenen bauen auf den ersten beiden Ebenen der Proteinstruktur auf. In diesem Abschnitt konzentrieren sich Diagramme häufig auf einfache Faltungsmuster und lineare Sequenzen.
Aminosäuresequenz
Die einzigartige Reihenfolge von Aminosäuren, die über Peptidbindungen verbunden sind, bildet die Primärstruktur. Genetische Information bestimmt die genaue Abfolge jedes Proteins. Schon der Austausch einer einzelnen Aminosäure kann das Verhalten eines Proteins verändern. Diese Kette enthält außerdem Information darüber, wie ein Protein so faltet, dass es funktionsfähig wird.
Die Primärstruktur wird in Diagrammen häufig dargestellt als:
- eine durchgehende Reihe verknüpfter Aminosäuren
- abgekürzte Aminosäurenamen oder -symbole
- eine Ausrichtung vom N-Terminus zum C-Terminus
Solche Diagramme helfen Lernenden zu erkennen, wie aus scheinbar einfachen Sequenzen komplexe Systeme entstehen.
α-Helices und β-Faltblätter
Die Sekundärstruktur entsteht, wenn sich eine Aminosäurekette aufgrund von Wasserstoffbrückenbindungen faltet. Die beiden häufigsten Muster sind:
- α-Helices: spiralförmige Windungen
- β-Faltblätter: gefaltete, zickzackartige Stränge
Diagramme zur Sekundärstruktur veranschaulichen diese Formen meist mit Bändern (Ribbons) oder Pfeilen. Diese Ebene zeigt, wie regelmäßige Faltungsmuster Stabilität und Grundform des Proteins verbessern, bevor die vollständige dreidimensionale Faltung entsteht.
Proteinstruktur-Diagramm mit EdrawMax erstellen
Proteinstruktur-Diagramme sollten präzise, logisch aufgebaut und leicht zu verstehen sein. EdrawMax ist ein benutzerfreundliches Diagramm-Tool. Es bietet spezifische Materialien für Biologie und Biochemie und eignet sich damit für unterschiedliche Zielgruppen. Mit integrierten Vorlagen und Symbolen lassen sich Proteinstrukturen klar und visuell ansprechend darstellen.
Biochemie-Vorlagen auswählen
EdrawMax bietet eine Reihe fertiger Vorlagen für die Biochemie – ein guter Ausgangspunkt.
- Vorlagen enthalten Standardsymbole für Polypeptidketten, α-Helices, β-Faltblätter und Aminosäuren.
- Layouts folgen gängigen wissenschaftlichen Konventionen.
- Vorlagen erhöhen die Genauigkeit und reduzieren die Designzeit.
Wählen Sie zum Start eine passende Vorlage. Klicken Sie im linken Bedienfeld auf die Schaltfläche „Vorlagen“, wählen Sie anschließend „Wissenschaft und Bildung“, und suchen Sie nach der gewünschten Biochemie-Vorlage.
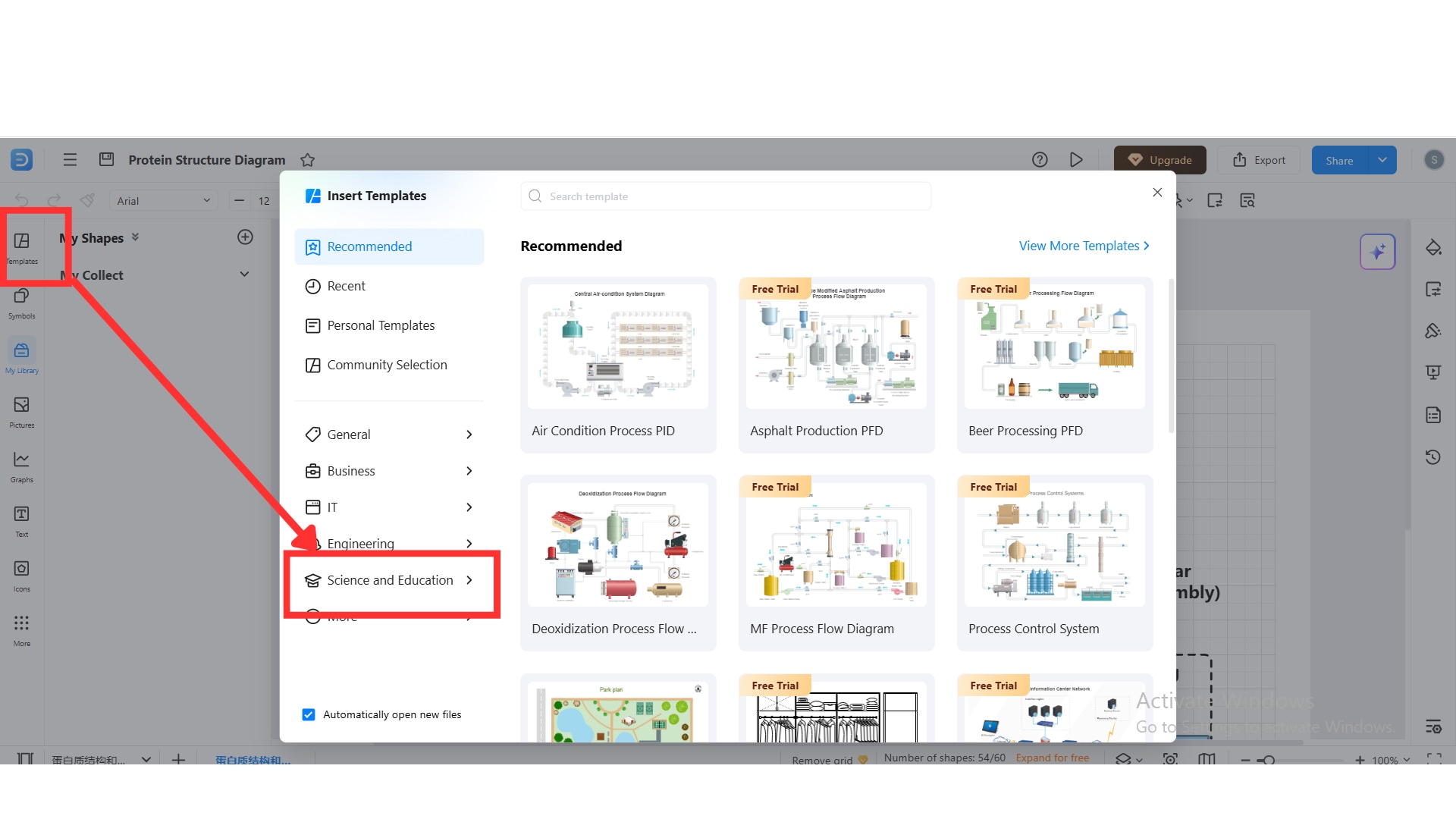
Jede Strukturebene zeichnen
Beginnen Sie damit, die Primärstruktur als Kette linearer Aminosäuren zu skizzieren. Dafür können Sie einfache, verbundene Formen oder beschriftete Symbole verwenden.
- Zeigen Sie N-Terminus und C-Terminus klar erkennbar.
- Nutzen Sie Beschriftungen, um Aminosäuresequenzen darzustellen.
- Halten Sie das Layout übersichtlich, damit es leicht nachvollziehbar bleibt.
Anschließend fügen Sie die Komponenten der Sekundärstruktur, z. B. Faltblätter und Helices, in unterschiedlichen Bereichen des Diagramms hinzu.
Faltungsmuster illustrieren
EdrawMax ermöglicht die Verwendung von bandartigen Formen und geschwungenen Verbindern, um die Tertiärstruktur darzustellen.
- Zeigen Sie, wie sich die Polypeptidkette zu einer kompakten, dreidimensionalen Form faltet.
- Nutzen Sie Kurven und Pfeile, um die Faltungsrichtung zu verdeutlichen.
- Nutzen Sie Farbcodierungen, um unterschiedliche Strukturbereiche zu unterscheiden.
Diese Ebene macht deutlich, wie Faltung zu funktionellen Proteinstrukturen führt.
Mehrstufige Diagramme erstellen
Um alle vier Ebenen in einer Abbildung zu zeigen, sind Mehrstufen-Diagramme besonders hilfreich.
- Ordnen Sie die Strukturen nach zunehmender Komplexität.
- Platzieren Sie Primär- und Sekundärstruktur auf einer Seite.
- Zeigen Sie Tertiär- und Quartärstruktur auf der anderen Seite.
- Diese Anordnung verbessert den konzeptionellen „Flow“ und erleichtert Vergleiche.
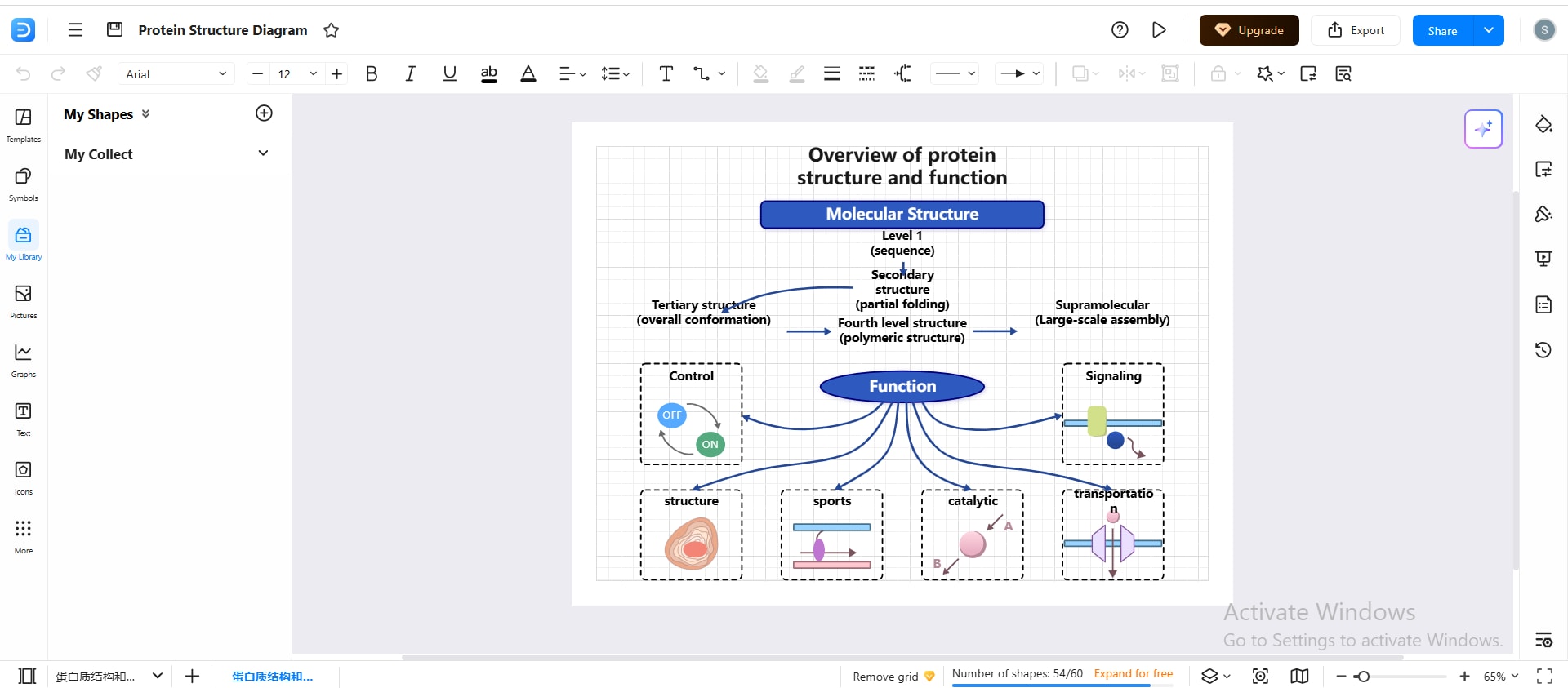
Darstellungen chemischer Bindungen ergänzen
Proteinstrukturen werden durch chemische Wechselwirkungen stabilisiert – diese sollten im Diagramm erkennbar sein.
- Fügen Sie Symbole für Disulfidbrücken und Wasserstoffbrückenbindungen hinzu.
- Kennzeichnen Sie hydrophobe und ionische Wechselwirkungen.
- Erläutern Sie Bindungstypen über eine Legende.
Dank der Annotationswerkzeuge von EdrawMax lassen sich diese Details ergänzen, ohne die Grafik zu überladen. Das fertige Diagramm können Sie anschließend für Berichte, Präsentationen oder Lehr-/Blogbeiträge exportieren.
Tertiär- und Quartärstruktur
Die Tertiär- und Quartärstruktur repräsentieren häufig die funktionellen Formen von Proteinen. Auf diesen Ebenen interagieren Proteine mit anderen Molekülen und erfüllen spezifische biologische Aufgaben.
3D-Faltung
Die vollständige dreidimensionale Faltung einer einzelnen Polypeptidkette wird als Tertiärstruktur bezeichnet. Protein-Stabilität und -Aktivität hängen von dieser Faltung ab. Sie wird durch Wechselwirkungen zwischen den Seitenketten (R-Gruppen) der Aminosäuren angetrieben.
- Stabilisiert durch Disulfidbrücken, hydrophobe Kontakte, ionische Wechselwirkungen und Wasserstoffbrückenbindungen
- Hydrophile Aminosäuren bleiben eher außen exponiert, während hydrophobe Aminosäuren nach innen „einpacken“.
- Jedes Protein nimmt eine kompakte, charakteristische Form an.
- Es entstehen aktive Zentren und Bindungstaschen, die für die biologische Funktion essenziell sind.
Wie ein Protein mit Liganden, Substraten oder anderen Proteinen interagiert, wird durch seine Tertiärstruktur bestimmt. Enzyme sind auf eine korrekte Faltung angewiesen, um Substrate passend zu positionieren und Reaktionen effizient zu katalysieren. Wird die Tertiärfaltung gestört, kann die Proteinfunktion abgeschwächt oder aufgehoben werden. Mutationen oder Umweltfaktoren wie pH-Wert und Temperatur können die Faltung beeinflussen.
Komplexe aus mehreren Untereinheiten
Proteine, die aus zwei oder mehr Polypeptidketten bestehen (Untereinheiten), besitzen eine Quartärstruktur. Jede Untereinheit trägt zur Gesamtfunktion des Proteinkomplexes bei und weist eine eigene Tertiärstruktur auf.
- Untereinheiten lagern sich über nichtkovalente Wechselwirkungen zusammen, z. B. Wasserstoffbrückenbindungen und ionische Kräfte.
- Einige Proteine nutzen zusätzlich Disulfidbindungen, um Untereinheiten-Verknüpfungen zu stabilisieren.
- Die Quartärstruktur ermöglicht kooperatives Verhalten zwischen Untereinheiten und erhöht Stabilität sowie funktionelle Regulation.
Hämoglobin ist ein bekanntes Beispiel dafür, wie mehrere Untereinheiten kooperieren, um Sauerstoff zu transportieren. Diagramme zur Quartärstruktur zeigen verschiedene Untereinheiten häufig in kontrastierenden Farbtönen. Dadurch lassen sich Anordnung und Interaktionen leichter visualisieren und verstehen.
Weitere kostenlose Vorlagen für Biologie-Diagramme entdecken
Für Forschende, Lehrkräfte und Studierende, die präzise und verständliche Visualisierungen der Proteinanordnung benötigen, sind kostenlose Proteinstruktur-Vorlagen hilfreiche Werkzeuge. Sie erleichtern die Erstellung von Diagrammen, weil sie vorgefertigte Layouts bereitstellen, die anerkannten biologischen Prinzipien folgen. In EdrawMax finden Sie unkompliziert kostenlose Vorlagen für nahezu jedes Biologie-Diagramm.
Fazit
Das Verständnis der Proteinstruktur ist entscheidend, um biologische Prozesse im Körper zu verstehen. Indem Proteinstruktur-Diagramme Struktur und Funktion visuell miteinander verknüpfen, werden biologische Konzepte leichter zugänglich. EdrawMax ist ein geeignetes Tool, um solche Diagramme zu erstellen.